China International Medical Devices Exhibition 2024
加快标准制定 助力新技术在医疗器械领域高质量运用——医用增材制造医疗器械全生命周期质量控制和行业标准建设进展介绍
□韩倩倩王春仁李静莉
当新技术应用到医疗器械研发生产中时,要关注因新技术引发的新风险,应用标准的方法来评估风险、评价产品的安全有效性,尽可能在现有技术条件下消除风险。保障新技术的安全应用至关重要。因此,要科学制定基于新技术研发生产的医疗器械的质量评价标准,使新技术在发展之初便得到标准化工作的支撑。有了标准的支撑,一方面,可以使新技术更好更快地应用于产品制造;另一方面,可以缩短产品的研发、验证、临床应用的总体转化时间。在医疗器械新技术应用领域,我国有望实现国际医疗器械研发制造的弯道超车,所以加强基于新技术研发生产的医疗器械的标准化研究,有助于产品上市前的科学把关、落实前瞻性全生命周期监管和规范产业发展。
增材制造技术应用于医疗器械的研发制造是新技术应用的范例。因增材制造技术涉及数据建模、医工交互、个性化定制等环节,所以产品的全生命周期质量管理尤为重要。2021年3月,国家药品监督管理局、国家标准化管理委员会发布了《关于进一步促进医疗器械标准化工作高质量发展的意见》,鼓励开展增材制造医疗器械领域的标准化工作。
国家药监局于2019年批准组织成立医用增材制造技术医疗器械标准技术归口单位,中国食品药品检定研究院作为归口单位秘书处承担单位,通过开展技术研究和组织标准制定,现阶段已经制定发布国家药监局行业标准两项,预研行业标准提案13项,建立了覆盖全生命周期质量控制环节的医用增材制造技术医疗器械行业标准体系。
行业标准研究先行
奠定产品高质量发展标准化基础
增材制造技术将生物医用材料、工程、数据、医学个性化需求交叉汇融,近年来得以逐步广泛应用。增材制造医疗器械产品类型包括医疗用模型、手术导板、骨科产品、组织修复产品、血管植入物、矫形器具等。现阶段增材制造技术产品获注册证14个,主要代表性产品有作为三类医疗器械管理的增材制造髋关节假体、颈椎融合器、骨盆缺损匹配假体;作为二类医疗器械管理的增材制造骨模型、截骨导板、种植牙定位导板等。已经进入临床研究的代表产品有增材制造纯坦骨科植入物、增材制造镍钛合金骨科植入物和增材制造陶瓷骨科植入物等。增材制造应用于医疗器械的制造具备独特的个性化实现和精密微观结构实现的优势,同时也带来了独有的风险。比如粉末状原材料质控缺乏技术指标,设备验证关键生产环节缺乏规范要求,成品检测方法匮乏等。所以,该领域的发展急需风险分析技术、质量控制技术和标准化工作的指导。
面对技术变革,中国食品药品检定研究院开展了医用增材制造医疗器械的检验技术和标准化技术研究,建立了涵盖原材料、工艺验证、设备、数据传输和风险管理的标准体系,并开展行业标准的制定。
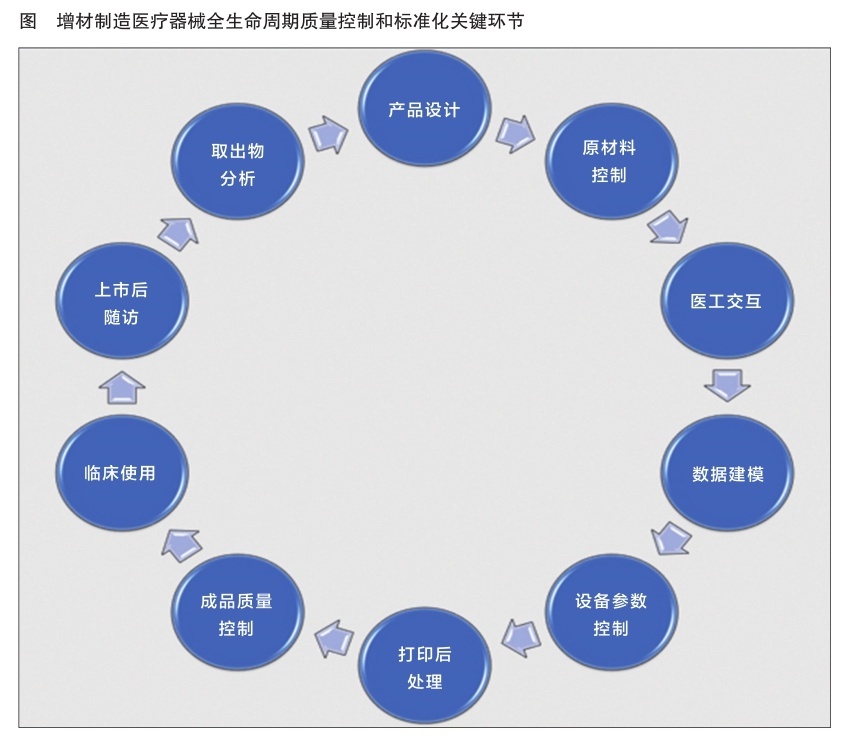
从支撑全生命周期监管的角度出发,中国食品药品检定研究院对涉及产品安全有效的各个环节展开研究,确定了十大关键技术和标准化环节,分别是产品设计、原材料质量控制、医工交互、数据建模、设备参数控制、打印后处理、成品质量控制、临床使用、上市后随访、取出物分析。针对各个环节征集标准立项提案,共预研了13项行业标准提案,其中现阶段已经制定发布了增材制造技术的基础性原材料标准YY/T 1701-2020《用于增材制造的医用Ti-6Al-4V/Ti-6Al-4V ELI粉末》、YY/T 1809-2021《医用增材制造 粉末床熔融成形工艺金属粉末清洗及清洗效果验证方法》,2021年度组织制定了一项关于用于增材制造的医用纯属坦粉末的行业标准。
着眼全生命周期质量控制
构建覆盖全环节的行业标准体系
完善的标准是质量可控的重要保障之一。根据增材制造医疗器械的特点,归口单位秘书处研究建立了10个质量控制及标准技术研究环节(详见图)。只有各个环节都做到满分,才能达到成品的质量可控。
产品设计增材制造医疗器械的设计包含外形设计和内部结构设计。增材制造医疗器械的临床应用优势是可以进行个性化定制,即根据患者的特殊病损进行设计。以骨植入类产品为例,可以设计独特的三维精密结构以增加其骨整合性,好的设计可以使骨整合更好、使功能发挥符合患者的个体特点。针对产品设计,现阶段已经有预研标准两项:骨植入物设计流程和骨科外固定器械仿生结构合理性评价。
原材料控制原材料的质量控制是打印产品质量的基础,对原材料进行质量控制是保证增材制造产品质量的基础。金属增材制造原材料为球形粉末状,如金属粉末、光敏树脂粉末、高分子粉末、陶瓷粉末等。针对增材制造原材料,应建立符合医疗器械生产需求的表征指标。针对医用增材制造技术医疗器械的特殊要求,归口单位在制定不同种类医用增材制造原材料的专用要求。目前,已发布一项钛合金粉末标准——YY/T 1701-2020;一项坦粉末标准,将于2021年底报批。预研形成两项生物陶瓷原材料标准提案,分别为β-磷酸三钙粉末和羟基磷灰石粉末。
医工交互医工交互是生产增材制造医疗器械设计的关键。医工交互是指医生与生产企业的工程技术人员有效沟通,并根据数据进行合理建模和设计。医生需针对患者的临床需求和适用性做出判断,准确采集临床数据。这些数据是建模的基础。
数据建模医用增材制造技术数据建模控制环节包括数据传输的安全性和有效性、数据处理方法的准确性、建模方法稳定性和准确性。目前,归口单位已经预研了医工交互平台建设的基本要求标准。
设备参数控制打印设备是实现增材制造医疗器械生产的重要硬件。设备运行的稳定性和打印工艺的稳定性决定了产品的批间差异是否在可接受范围内。打印设备的打印参数要有严格的验证程序,确保打印工艺的可实现性和稳定性。有必要针对不同成型工艺的要求,如挤出式、能量直接沉积、激光熔融等,建立专用于增材制造医疗器械的打印设备的通用要求和专用要求、设备参数运行稳定性的验证方法、设备改装控制方法等。归口单位已经征集到两项预立项研究提案,分别为粉末床电子束熔融工艺控制与确认、PEEK熔融沉积增材制造稳定性。
打印后处理打印的初步产品需经过必要的后处理,如消除热应力、表面粗糙度处理、去除粉末残留等。这些后处理是产品的合理力学性能和生物相容性的重要保证。针对加工工艺稳定性验证,已经制定发布了YY/T 1809-2021《医用增材制造粉末床熔融成形工艺金属粉末清洗及清洗效果验证方法》。
成品质量控制成品质量控制方面需要根据增材制造所带来的特殊风险展开研究,建立针对医用增材制造技术的专用测试方法,包括机械测试方法,如力学测试方法和非破坏性测试方法;化学特性测试方法,如晶型结构成分检测方法;生物学特殊风险评价方法,如仿生结构合理性评价方法和微粒的毒理学效应评价方法。
临床使用对于罕见特殊病损所需的定制式增材制造医疗器械,在按照《定制式医疗器械监督管理规定(试行)》实行备案制管理的基础上,还应加强各个环节所需具体实施规范的研究。医疗机构应当建立定制式医疗器械查验记录制度,定制式医疗器械的制作订单、产品验收、调改、使用、退回等信息以及与使用质量安全密切相关的必要信息应妥善保存,以确保信息具有可追溯性,并在病历中记录定制式医疗器械产品的名称和唯一识别编号。医疗机构应当对使用后的定制式医疗器械开展评价工作。由医疗、护理、临床工程技术、医院感染控制、生产企业技术人员等组成评价工作技术团队,对定制式医疗器械使用的实际效果和质量安全情况进行分析评价,并将此评价结果作为后期合理使用的重要依据。
上市后随访针对植入人体后的增材制造医疗器械,要加强随访。医疗机构应当制定完善的安全风险防范措施和风险控制计划,发生严重不良事件等紧急情况时,要立即启动应急预案,采取防范控制措施,及时处置。
取出物分析如遇不良事件需取出植入物时,要建立取出的操作流程和取出后产品的测试分析技术,找出产品失效原因。
全行业加强联动
构筑安全有效应用的有利环境
产、学、研、检、医、标准化研究机构和监管部门各个环节的密切配合,是增材制造医疗器械安全有效应用的保障。在全行业联动的过程中,标准也是链接各个环节的重要技术“语言”。
因增材制造技术应用于医疗器械生产仍缺乏经验,研发机构要加强打印技术原理的研究,开发更适合的原材料和精密度更高且拥有自主知识产权的设备和建模软件。生产者要做好生产管理,提高打印精密度和可控性。面对增材制造技术人才和医工交互人才匮乏的现状,有必要在高校或职业学校设立相关专业,培养相关产业工人和技术人才。检测研究机构承担增材制造医疗器械的质量评价,需要加强检测方法和工艺验证方法的研究。标准化研究机构要加强该领域的相关研究,研制急需的标准,使产品研发和验证有据可依。法规制定部门也应紧密追踪技术和产业发展趋势,制定适合的监管法规,规范产业发展。
只有加强全行业联动,共同贡献智慧和经验,才能使新技术在医疗器械领域的应用达到安全、有效、质量可控。